L’analyse quantitative des médicaments est fondamentale pour garantir leur efficacité et leur sécurité. Elle permet de déterminer précisément la quantité de substance active présente dans chaque dose.
📊 Composition centésimale
La composition centésimale exprime le pourcentage de chaque élément dans un composé chimique. Pour un médicament, cela correspond au pourcentage de substance active. Formule générale de la composition centésimale :
![]()
Exemple pratique : Calcul de la composition centésimale du paracétamol (C₈H₉NO₂) Masse molaire du paracétamol :
![]()
Pourcentage de carbone :
![]()
🧪 Concentrations des solutions médicamenteuses
La concentration massique est particulièrement importante en pharmacie :
![]()
où :
– Cm : concentration massique (g/L)
– m : masse de soluté (g)
– V : volume de solution (L)
Exemple : Préparation d’une solution de glucose à 5% Pour 100 mL de solution :
![]()
📈 Concentration molaire
La concentration molaire est essentielle pour les calculs stoechiométriques :
![]()
où :
– C : concentration molaire (mol/L)
– n : quantité de matière (mol)
– V : volume (L)
Relation entre Cm et C :
![]()
🔍 Application : Analyse d’un sirop contre la toux
Un sirop contient 15 mg de dextrométhorphane par 5 mL. Calculons sa concentration :
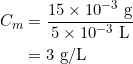
💡 Récapitulatif
- 🎯 La composition centésimale donne le pourcentage massique des éléments
- 🧪 La concentration massique s’exprime en g/L
- ⚗️ La concentration molaire s’exprime en mol/L
- 📊 Les deux concentrations sont reliées par la masse molaire
Astuce mnémotechnique : « CM = Masse/Volume » comme « Concentration Massique » !

