Les réactions organiques sont au cœur de la synthèse des médicaments. Comprendre leurs mécanismes permet d’optimiser la production des principes actifs.
🔑 Réaction de substitution
La substitution remplace un atome ou groupe par un autre. En série aromatique, c’est fondamental pour modifier les propriétés des molécules.
Exemple : Nitration du benzène
![]()
Cette réaction introduit un groupe nitro, première étape vers les anilines utilisées dans nombreux médicaments.
➕ Réaction d’addition
L’addition ajoute des atomes sur une liaison multiple. Très importante pour fonctionnaliser les alcènes et alcynes.
Addition d’eau sur un alcène (hydratation) :
![]()
Mécanisme électrophile :
- Attaque de H⁺ sur la double liaison
- Formation d’un carbocation
- Attaque de H₂O
- Déprotonation
🔥 Réaction d’élimination
L’élimination crée une liaison multiple en éliminant des atomes adjacents. Essentielle pour générer des alcènes.
Déshydratation des alcools :
![]()
Cette réaction suit généralement la règle de Zaïtsev : formation préférentielle de l’alcène le plus substitué.
🔄 Réaction d’estérification
L’estérification est cruciale pour synthétiser les esters, nombreux en pharmacie (aspirine, parfums).
Réaction entre un acide carboxylique et un alcool :
![]()
Exemple : Synthèse de l’aspirine (acétylsalicylate)
![]()
🎯 Mécanisme de l’estérification de Fischer
Le mécanisme se déroule en plusieurs étapes :
- Protonation du carbonyle
- Attaque nucléophile de l’alcool
- Transfert de proton
- Élimination d’eau
- Déprotonation
Représentation énergétique :
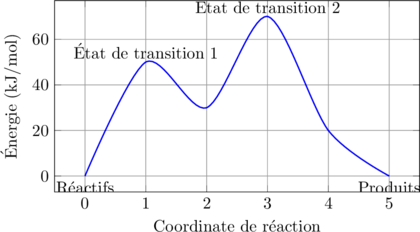
⚡ Réaction d’oxydo-réduction
Les réactions redox modifient le degré d’oxydation des atomes de carbone. Essentielles pour les transformations fonctionnelles.
Oxydation des alcools :
- Alcool primaire → Aldéhyde → Acide carboxylique
- Alcool secondaire → Cétone
- Alcool tertiaire → Résistant à l’oxydation douce
![]()
🔬 Réaction acide-base en milieu organique
Les propriétés acide-base influencent la solubilité et la biodisponibilité des médicaments.
Constante d’acidité :
![]()
pKa = -log Ka
Exemple : Acide acétique (vinaigre) pKa = 4,76
💊 Application : Synthèse d’un médicament simple
Synthèse du paracétamol à partir du phénol :
- Nitration du phénol
- Réduction du groupe nitro en amine
- Acétylation de l’amine
Étape d’acétylation :
![]()
💡 Récapitulatif des réactions
- 🔑 Substitution : Remplacement d’atomes
- ➕ Addition : Sur liaisons multiples
- 🔥 Élimination : Formation de doubles liaisons
- 🔄 Estérification : Synthèse d’esters
- ⚡ Oxydo-réduction : Changement d’état d’oxydation
Astuce mnémotechnique : « S-A-E-E-O » pour se souvenir des cinq types de réactions fondamentales !
Ces réactions sont la base de la synthèse de la majorité des médicaments modernes. Leur maîtrise est essentielle pour tout chimiste pharmaceutique.

